Enfermedades Bacterianas:
S. pullorum y S. gallinarum. Salmonella:
Son las infecciones de las gallinas por salmonelas diversas. Los pollitos afectados están inmóviles, con la cabeza baja y los ojos cerrados, para aparecer unos días más tarde en ellos una diarrea grisáceo-verdosa que mancha fuertemente el plumón peri cloacal.
Cuando se da este problema y se indagan los antecedentes del nacimiento en la incubadora, posiblemente se hayan podido constatar en la operación un elevado número de pollitos muertos en el huevo o huevos abortados.
Las medidas preventivas consisten en la administración de antibióticos de amplio espectro a los pollitos recién adquiridos.
tratamiento que se prolongará durante cuatro o cinco días. La profilaxis se basará en la estricta limpieza, frecuente recogida de los huevos, desinfección del equipo de incubación, separación de los huevos sucios para no incubarlos.
Las salmonelas, además de causar enfermedades en mamíferos, aves y animales de sangre fría, constituyen una de las principales causas de toxiinfecciones de origen alimentario en el hombre, donde las aves y subproductos juegan un papel importante como fuente de infección.
En las aves, las salmonelas diferentes a los huéspedes específicos
S. pullorum y S. gallinarum, son denominadas salmonella paratifoidea. Estas pueden ser responsables de infecciones asintomáticas en algunos casos o producir la enfermedad conocida con el nombre de infección paratifoides o paratifosis aviar.
Esta enfermedad mantiene como una de las principales causas de pérdidas significantes en la industria avícola mundial.
Las aves comerciales constituyen uno de los principales reservorios de salmonelas, siendo la carne de pollo y los huevos contaminados la fuente más importante de contaminación para el hombre (Humphrey y col., 1988; William y col., 1998).
Las infecciones de aves domésticas con salmonelas son costosas, tanto para la industria avícola como para la sociedad en general. Los costos asociados con infecciones de las aves, se pueden ubicar en dos grandes aspectos, uno relacionado con los gastos por concepto de toxiinfección en los humanos causada por el consumo de alimentos contaminados.
En los Estados Unidos de Norteamérica, el Departamento de Agricultura (1995) estima que para 1993, los costos fueron superiores a 3,5 billones de dólares por concepto de medicinas y baja productividad, como consecuencia de toxiinfecciones alimentarias en humanos.
Otro aspecto involucra los diversos gastos relacionados directamente con la producción avícola como consecuencia de las infecciones por salmonelas, las cuales en aves jóvenes pueden ocasionar hasta 80 % de morbilidad. En aves maduras, los costos pueden ser muy elevados en términos de esfuerzos requeridos para prevenir la transmisión de la infección a la progenie o a los humanos.
Medidas de bioseguridad, desinfección, vacunación, programas de control, encarecen de una manera significativa los costes productivos.
En Estados Unidos se han aislado un total de 203 especies de salmonellas paratifoides pertenecientes a una gran variedad de serogrupos de pollos y pavos. Muchos de estos aislamientos fueron obtenidos de pollos y pavos jóvenes con infecciones agudas, y otras de aves asintomáticas (Nagaraja y col., 1991 ).
En Venezuela se han identificado 33 serotipos de salmonelas paratifoides, pertenecientes a los serogrupos B, C, D, E, G, J, K, R y O, siendo las más frecuentes los pertenecientes a los serogrupos B y C (Infante y col., 1986).
Agente etológico:
El género Salmonella, pertenece a la familia de las Enterobacteriaceae y está dividido en seis subgéneros diferentes. Se han identificado más de 2.430 serovariedades, siendo algunas de ellas huésped específico de una especie en particular, como S. typhi en humanos y S. gallinarum-pullorum en aves. Estas dos últimas son las únicas especies inmóviles en la naturaleza.
Transmisión:
Las salmonelas paratifoides pueden ser transmitidas horizontalmente por una variedad de fuentes, consideradas entre las más frecuentes el alimento contaminado, las aves portadoras, roedores, las aves silvestres y el medio ambiente en general.
Otra forma de transmisión es a través del huevo, la cual puede ocurrir transovárica mente de aves portadoras a la descendencia (vertical) o por penetración de las salmonelas a través de los poros de la cáscara de huevos como consecuencia de contaminación con materia fecal.
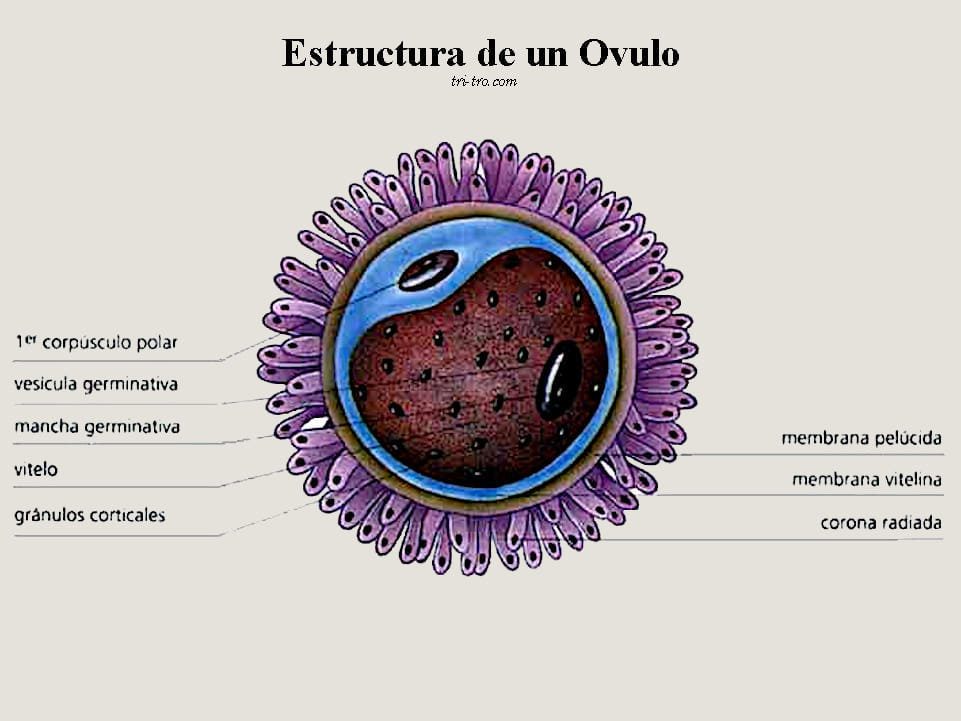
Para que ocurra la transmisión transovárica, la bacteria tiene que interactuar con los componentes del folículo preovulatorio, el cual está constituido de adentro hacia afuera por una masa de vitelo rodeada por una membrana perivitelina, luego una capa granulosa de células, una membrana de base y la lámina de células tecales (Figura 1).
Estudios realizados con S. enteritidis ilustran la transmisión transovárica. Esta puede ocurrir por adherencia de la bacteria a ciertos componentes celulares del folículo preovulatorio, entre ellos las células granulosas, las cuales poseen en la superficie ciertas estructuras que median esta adherencia y pueden ser un posible blanco para la colonización del ovario.
La S. enteritidis también puede invadir con fuerza paredes del folículo y pasar a través de ellas a la yema del huevo (Thiagarajani y col., 1994).
Figura 1. Estructura del folículo preovulatorio.
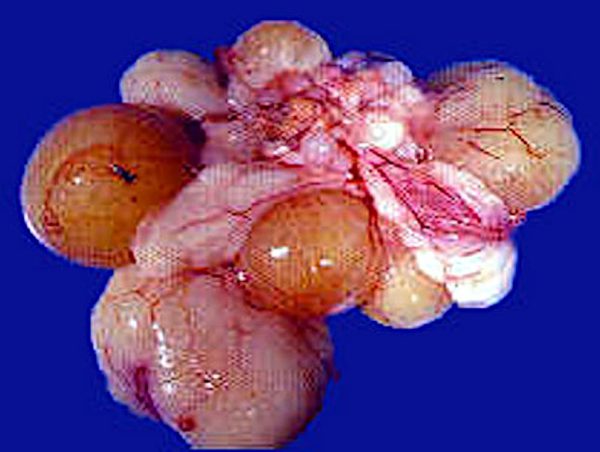
Figura 2. Pericarditis producida por Salmonella enteritidis.
Figura 3. Óvulos flácidos, pálidos, mal implantados y hemorrágicos, causados por Salmonella paratifoidea.
Patogenicidad:
Intervienen diversos factores y la evolución de la infección está determinada por el serotipo involucrado, edad de las aves, dosis infectante, estado inmunológico y otras condiciones predisponentes.
Se han descrito tres tipos de toxinas de naturaleza proteica que juegan un papel importante en la patogenicidad de salmonelas paratifoideas.
Una endotoxina asociada con la porción A del lipopolisacárido (LPS) de la célula bacteriana, la cual puede ser responsable del cuadro febril y ocasionar lesiones en el hígado y el bazo.
Ese LPS contribuye además a la resistencia de la bacteria al ataque y digestión por los fagocitos del huésped.
Una enterotoxina termolábil es capaz de inducir la respuesta secretora de las células epiteliales, resultando en acumulación de fluidos en el lumen del intestino y una citotoxina termoestable es responsable de los daños en la estructura de las células epiteliales del intestino por inhibición de la síntesis de la proteína.
Otro de los factores que intervienen en la patogenicidad, es la capacidad que tienen las salmonelas de adherirse a las células epiteliales intestinales. Esa adherencia está asociada con la presencia de ciertas estructuras como las fimbrias tipo 1 y con una hemo aglutinina manosa resistente. La invasión posterior de los tejidos requiere de la síntesis de proteína de la bacteria.
Los plásmidos confieren a las salmonelas cierta especificidad, directamente vinculada con la virulencia de ciertos números de cepas, la cual está relacionada con la invasión de nódulos linfoides mesentéricos, hígado y bazo en ratones infectados experimentalmente.
Infecciones paratifoideas:
Las aves jóvenes son muy susceptibles a las infecciones por salmonelas paratifoides, mientras que las adultas son más resistentes a los efectos letales de estos microorganismo. Normalmente el primer evento que ocurre en el proceso infeccioso es la colonización intestinal, la cual puede acompañarse de excreción del germen por las heces.
En muchas de las aves infectadas ocurre invasión del tracto gastrointestinal, con multiplicación de la salmonela en el tejido reticuloendotelial del hígado y bazo. Eventualmente se produce invasión de otros tejidos internos y finalmente puede presentarse bacteriemia, causando ocasionalmente elevada mortalidad.
Signos clínicos:
Las infecciones paratifoideas generalmente muestran signos de enfermedad sólo en aves muy jóvenes. En pollos y pavos recién nacidos, se puede desarrollar septicemia con elevada mortalidad sin ninguna manifestación clínica.
En infecciones severas se observa somnolencia, alas caídas, plumas erizadas, anorexia, emaciación, frecuentemente se presenta diarrea, empastamiento de la región anal y deshidrataciÓn, con alta morbimortalidad. La mortalidad en aves jóvenes varía entre 10 y 20 %, y en brotes severos puede alcanzar hasta 80 %.
En aves adultas, generalmente no hay manifestaciones clínicas, siendo raros los brotes agudos, los cuales son de corta duración, observándose inapetencia, incremento en el consumo de agua, diarrea, deshidratación, decaimiento, baja de la postura y la mortalidad no excede de 18 %.
Lesiones macroscópicas:
Infecciones severas en pollos recién nacidos pueden producir septicemia, causando alta mortalidad sin observarse lesiones aparentes.
Cuando el curso de la enfermedad es más prolongado, se observa enteritis severa, acompañada de lesiones focales necróticas en la mucosa del intestino delgado. Además comúnmente se observan hígado y bazo congestionados con puntillado hemorrágico o focos necróticos.
En casos de cepas altamente virulentas e invasivas se produce frecuentemente pericarditis y perihepatitis fibrinopurulenta (Figura 2). También es frecuente la retención del saco vitelino con cambios de aspecto y consistencia. Otras lesiones como panoftalmitis, aerosaculitis y onfalitis ocurren ocasionalmente.
En aves maduras, en brotes agudos se observa inflamación y congestión del hígado, bazo y riñones, enteritis necrótica o hemorrágica, pericarditis, perihepatitis; óvulos flácidos, pálidos, mal implantados, hemorrágicos y huevos retenidos en cavidad abdominal (Figura 3).
Los portadores crónicos frecuentemente no presentan lesiones, pero en algunos casos se ha observado emaciación, necrosis del intestino, hígado, bazo y riñones hipertrofiados, nódulos en el corazón y óvulos deformes.
Bibliografía
Gast, R K, 1997. Paratyphoid infections. Diseases of poultry. Ed by B. W. Calnek; H. Jhon Barnes; Charles W. Beard; Larry R. McDougar and Y. M. Said. Tenth edition. lowa State University Pres. Ames, lowa. USA.
Humphrey, T, G. Mead and B. Rowe. 1988. Poultry meat as source of Human salmonellosis in England and Wales. Epidemiollnfect. 100:175-184.
Infante, D.; A. J. León; C. de Noguera; C. A. Quiroz; A. J. Herrera y P. Valdillo. 1986. Serovariedades de salmonelas paratifoides aisladas de aves durante 1976-1986. Vet. Trop. 11:3-8.
Nagaraja, K. V.; B. S. Pomeroy and J. E. Williams. 1991. Paratyphoid infections. Diseases of poultry Ed. by B. W. Calnek; H. Jhon Barnes; C. W. Beard; W. M. Reid and H. W. Yoder, Jr. Ninth edition. lowa State University Press. Ames, lowa, USA.
Thiagarajan, D.; A. M. Saeed and E. K. Asem. 1994. Mechanism of transovarian transmission of Salmonella enteritidis in laying hens. Poultry Sci. 73: 89-98.
Williams, A.; A. C. Davies; J. Wilson; P. D. Marsh.; S. Leach and T. J. Humprey. 1998. Contamination of the contents of intac eggs by Salmonella typhimurium. DT 104. Vet. Rec. 143.562-563.
Os pueden interesar estos otros apartados
Quieres compartir, o comentar en tus redes sociales.
Escanéame