Enfermedades Bacterianas:
Clostridium perfringens. Enteritis necrótica:
Enfermedad en las aves que se conoce también con el nombre de enteritis catarral maligna. La enfermedad se presenta de forma súbita, aparecen aves muertas y se observa la presencia de deyecciones líquidas malolientes. Es una enfermedad aguda que produce una marcada destrucción de la mucosa intestinal.
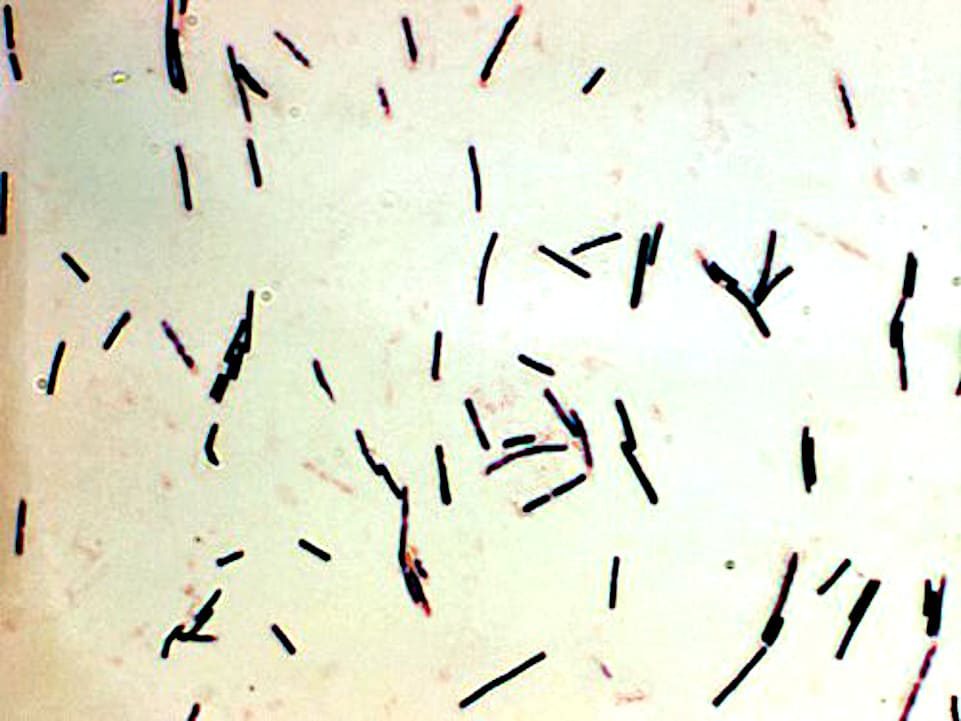
El agente causal de la enfermedad es el Clostridium perfringens, una bacteria en forma de bastón, que forma esporas. Las aves muy afectadas suelen estar muy abatidas, dejan de comer y beber y muestran un aspecto absolutamente somnoliento.
A veces muestran una parálisis flácida y fuerte palidez de la cresta y las barbillas.
En los pollitos se han descrito manifestaciones paralíticas e incluso temblores, que podrían confundir el proceso.
Las formas subagudas causan aumento de la sed y presentan la cloaca húmeda.
Etiología:
La enteritis necrótica se ha asociado con los tipos A y C de Clostridium perfringens. Es más frecuente en animales que viven en instalaciones con camas de paja.
Es probable que la enterotoxemia sólo se manifiesta cuando existe una alteración importante de la microflora bacteriana del intestino.
Estas alteraciones pueden ser el resultado de cambios del contenido intestinal ocasionados por variaciones de la calidad o la cantidad de los alimentos ingeridos, una reducción de la motilidad de los intestinos, lesiones de la mucosa intestinal producidas por microorganismos agresivos (por ejemplo, enteritis hemorrágica de los pavos, salmonelas, larvas de ascáridos) o toxinas.
Estos cambios pueden fomentar la colonización por clostridios y la producción inmediata resultante de toxinas. La enteritis necrótica ha sido reproducida experimentalmente mediante la infusión en el duodeno de numerosas células con clostridios y toxina preformada.
Lesiones y diagnóstico:
Las aves infectadas están deprimidas y pueden presentar diarrea. Los síntomas clínicos se desarrollan rápidamente y la muerte aparece a las pocas horas.
La pechuga muestra un aspecto deshidratado y oscuro y el hígado normalmente está tumefacto y congestionado.
El intestino delgado tiene forma de globo y es friable, conteniendo un líquido pardo y maloliente.
La mucosa está cubierta de una membrana diftérica de color pardo.
La enfermedad persiste en el grupo durante 5-10 días y la mortalidad oscila entre el 2 y el 50 %.
Ayuda a establecer un diagnóstico preliminar la presencia de un número elevado de bacilos cortos, gruesos y grampositivos, que se observan en un frotis teñido, que se prepara a partir de raspados de la da mucosa.
Los hallazgos histológicos comprenden necrosis coagulante en un tercio de o la mitad del espesor de la mucosa, que tal se acompaña de masas de bacilos cortos y gruesos en los restos fibro necróticos. Se puede aislar Clostridium perfringens en el contenido intestinal mediante cultivos o anaerobios.
Las lesiones producidas por Eimeria brunetti pueden ser similares a las de la enteritis necrótica, pero la coccidiosis sin complicaciones rara vez es tan aguda o grave.
La enteritis ulcerativa puede asemejarse clínica-mente a la enteritis necrótica, pero las lesiones intestinales son normalmente focales, se localizan en el íleon, ciego y recto, se acompañan de lesiones necróticas en el hígado.
Tratamiento y control:
Reducen al mínimo el riesgo de enteritis necrótica la implantación de un control sanitario estricto y los esfuerzos para evitar la coccidiosis, la salmonelosis y otras infecciones intestinales.
Deben evitarse los cambios drásticos de la alimentación y hay que vigilar los alimentos y el agua para descubrir contaminantes que alteran la motilidad intestinal o desvitalice su mucosa.
El disalicilato metilénico de bacitracina es eficaz para evitar y tratar la enteritis necrótica.
Las concentraciones preventivas son COI de 50 g/tonelada (55 ppm) en el alimento; las concentraciones terapéuticas son un de 100-200 g/tonelada (110 a 220 ppm).
Se ha demostrado que también son eficaces la penicilina, la eritromicina y las tetraciclinas, administradas a una dosis de 20 ppm en el alimento.
Bibliográfica:
MERCK & CO. (1995). Manual Merck de Veterinaria . Rahway, N. J., EEUU.
BUXADÉ, P. (1987). La gallina ponedora . Ed. Mundiprensa. Madrid.
DORN, P. (1987). Manual de patología aviar . Ed. Acribia. Zaragoza.
HOFSTAD, M. S. (1984). Diseases of Poultry . Iowa State University Press, Ames, Iowa.
ZARZUELO, E. (1982). Vademécum de la patología infecciosa de las aves domésticas . Ed. Aedos, Barcelona.
CASTELLÓ, F y CASTELLÓ, J. A. (1960). El nuevo arte de criar gallinas. Ed. Aedos, Barcelona.
OROZCO, F. (1989). Razas de gallinas españolas. Ed. Mundiprensa. Madrid.
LACADENA, J. R. (1998). Genética . Ed. AGESA
PUERTAS, M.J. (1992). Genética, fundamentos y perspectivas. Ed. Interamericana McGraw – Hill.
SANCHEZ-MONGE, E. (1969), Genética . Ed. Espasa – calpe S.A.
OROZCO,F y ROBLA, F. (1986). Aspectos genéticos del gallo de León. XXIV Simposio de la WPSA (Sección española): 199 – 212.
DE LA LOMA, J.L. (1973). Genética general y aplicada . Ed. UTEHA.
CASTELLÓ, J.A., LLEONART, R., CAMPO, J.L., OROZCO, F. (1989). Biología de la gallina. Real Escuela de Avicultura.
LLEONART, F. ROCA, E. CALLÍS, M. GURRI, A. PONTES, M. (1991). Higiene y patología aviares . Real escuela de avicultura.
STURKIE, P.D. (1968). Fisiología Aviar. Ed. Acribia. Zaragoza.
LOHMANN ANIMAL HEAFTH (2012)
Os pueden interesar estos otros apartados
Quieres compartir, o comentar en tus redes sociales.
Escanéame