Un estudio genético desvela el mecanismo que hace que muy pocas aves tengan pene.Estudio realizado en la Universidad de Florida desvela el mecanismo genético que indica que muy pocas aves tengan falo. Ver vídeo al final del post para su compresión.
En el transcurso del crecimiento del embrión, los pollos empiezan a desarrollar un tubérculo genital, que es el predecesor del falo, ocurriendo que en un cierto momento, se activa un proceso de muerte celular llamado apoptosis (es una vía de destrucción o muerte celular programada o provocada por el mismo organismo, con el fin de controlar su desarrollo y crecimiento) y el órgano empieza a encogerse hasta desaparecer, antes de que el ave salga del cascarón.
Lo más destacado
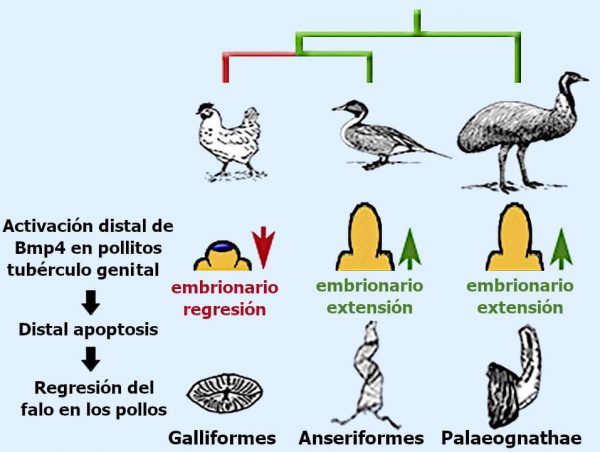
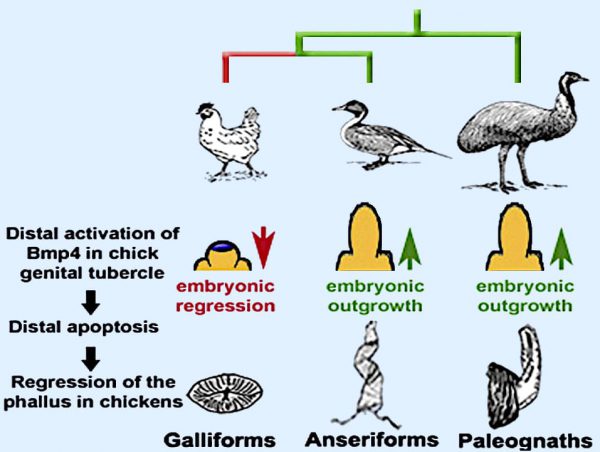
- Durante la evolución de las aves, el falo se redujo o se perdió en la mayoría de los linajes.
- Los pollos forman un falo reducido, pero se conservan los mecanismos primitivos de crecimiento.
- Un dominio Bmp4 derivado, provoca apoptosis y regresión del falo embrionario de los pollitos.
- Las aves basales y los patos carecen de manifestación distal de Bmp4 pudiendo desarrollar falos alargados.
Antecedentes
Uno de los hechos más desconcertantes de la evolución, es la reducción y pérdida del falo en las aves.
Todas las aves se reproducen por fertilización interna, pero sólo el 3% de ellas han retenido un falo con capacidad de penetración.
Se han propuesto varias hipótesis para los mecanismos evolutivos que impulsaron la reducción del falo; sin embargo, se desconocen los mecanismos de desarrollo subyacentes.
Pocos caracteres morfológicos en el reino animal rivalizan con la diversidad, complejidad y evolución de los genitales externos masculinos. Entre los animales con fertilización interna, la morfología genital evoluciona rápidamente, el tamaño, la forma y los detalles anatómicos de los genitales externos pueden mostrar una variación dramática.
Ejemplos más llamativos de la diversificación evolutiva, tanto de la forma y función genital se encuentran en las aves. De hecho, los genitales externos están reducidos o ausentes en casi 10.000 especies de aves. Estos cambios evolutivos han dado lugar a morfologías del falo que pueden clasificarse operativamente en tres categorías generales:
- Un falo intermitente que es capaz de insertarse durante la cópula (por ejemplo, patos).
- Un falo no intermitente que se reduce pero no se pierde (por ejemplo, pollos).
- Ausencia del falo que implica una pérdida completa de una protuberancia fálica (por ejemplo, neo aves el grupo más grande de aves).
Aunque la mayoría de las galliformes sufrieron una reducción extrema de los genitales externos, los miembros de su clan hermano, los anseriformes, conservaron un falo intermitente, y en algunas especies estos órganos en espiral alargados pueden exceder la longitud del cuerpo.
Estas alteraciones morfológicos llevaron a cambios en las estrategias de cópula en diferentes linajes.
Por ejemplo, los machos que carecen de un órgano intermitente o prominente transfieren los espermatozoides mediante la aplicación de la cloaca con la de la hembra, en una maniobra conocida como el «beso cloacal», que requiere la cooperación de la hembra, ese es el caso de nuestras gallinas.
Por el contrario, los machos con falo pueden manipular a las hembras e incluso copular por la fuerza con hembras involuntarias, un comportamiento que está bien documentado en las aves acuáticas.
Aunque las presiones selectivas para obtener morfologías del falo elaboradas son obvias, no está tan claro cómo la selección podría favorecer la reducción o pérdida. Se han propuesto varias hipótesis;
- Una de las hipótesis más influyentes para la diversidad genital, es la del «candado y la llave«, sostiene que la rápida evolución de los genitales facilitó la especialización a través de la incompatibilidad reproductiva (es decir, sólo los machos y las hembras de la misma especie pueden encajar sus genitales juntos).
- La segunda hipótesis Mayr propuso que la morfología genital sufre cambios frecuentes debido a los efectos pleiotrópicos. No está claro por qué los cambios neutros resultantes de la pleiotropía (es el fenómeno por el cual un solo gen es responsable de efectos fenotípicos o caracteres distintos y no relacionados), afectarían a los genitales de manera desproporcionada, aunque los estudios del control genético del desarrollo genital han identificado una multitud de mecanismos de desarrollo (incluyendo elementos reguladores del ADN que actúan) que son compartidos por otros sistemas de órganos.
- Una tercera hipótesis sostiene que la diversificación de los genitales externos ha sido impulsada por la selección sexual que actúa sobre la variación, eso afecta la competencia espermática, las características sensoriales de la morfología genital, la elección femenina y la adaptación sexualmente antagónica (es decir, los machos y las hembras evolucionan adaptaciones y contra adaptaciones para ganar control sobre la cópula y la fertilización).
El progreso reciente en la biología en el desarrollo de los genitales externos de los mamíferos ha llevado a la identificación de vías genéticas que controlan el crecimiento y el patrón del pene.
Estos descubrimientos, junto con avances independientes en filogenia aviar, ecología reproductiva y morfología comparativa, crean una nueva oportunidad para investigar las bases genéticas del desarrollo de la evolución genital en las aves.
Los mismos mecanismos que regulan el desarrollo del pene de los mamíferos también operan en los genitales externos de las aves, ya que las señales proliferativas que dirigen el crecimiento genital directo se conservan en los embriones de pollos (una galliforme) y de pato (una anseriforme) a pesar de las sorprendentes diferencias en su genital adulto.
Aunque el desarrollo temprano del tubérculo genital (el precursor del falo) se conserva en pollos y patos, encontramos que los pollos tienen un dominio único de muerte celular distal. Este dominio de la muerte celular está asociado con la activación ectópica (de un gen en un tejido donde no se expresa normalmente), del gen que codifica la proteína 4 morfogenética ósea (Bmp4).
Evolución de la reducción del falo en aves
La marcada divergencia de la morfología genital entre anseriformes y galliformes plantea interrogantes sobre las presiones selectivas que llevaron a la reducción fálica. La pérdida de órganos intromitentes es una paradoja evolutiva:
¿cómo puede la reducción de una estructura que facilita la fertilización interna tener un efecto positivo en la aptitud reproductiva?
Es poco probable que la reducción del falo sea el resultado para una mejor entrega del esperma.
Darwin propuso por primera vez que los caracteres variables, sin valor adaptativo aparente, no estaban sujetos a la selección natural, pero que estos rasgos podrían estabilizarse en una población si confirieran una ventaja «sobre otros individuos del mismo sexo y especie, en relación exclusiva con la reproducción».
La copulación con machos que carecen de un falo intromitente requiere la cooperación femenina, como la presentación de la cloaca y la eversión de la vagina. En consecuencia, al seleccionar los machos con falo reducido o no intromitente, las hembras pueden controlar la paternidad, lo cual es consistente con la idea de que la elección femenina desempeñó un papel en la reducción y pérdida del falo.
Una alternativa a la hipótesis de la selección sexual es que la reducción del tamaño del falo puede haber sido un efecto secundario de los cambios de desarrollo a otros caracteres.
Los mecanismos moleculares del desarrollo del apéndice se han conservado profundamente durante la evolución animal, y las redes de genes que regulan el desarrollo de los genitales externos también controlan la formación de una amplia gama de otras estructuras, incluidas las extremidades, el intestino, el sistema nervioso, el músculo y los apéndices in tegumentarios, como plumas y escamas. Además, la expresión específica del tejido de varios genes expresados en el tubérculo genital.
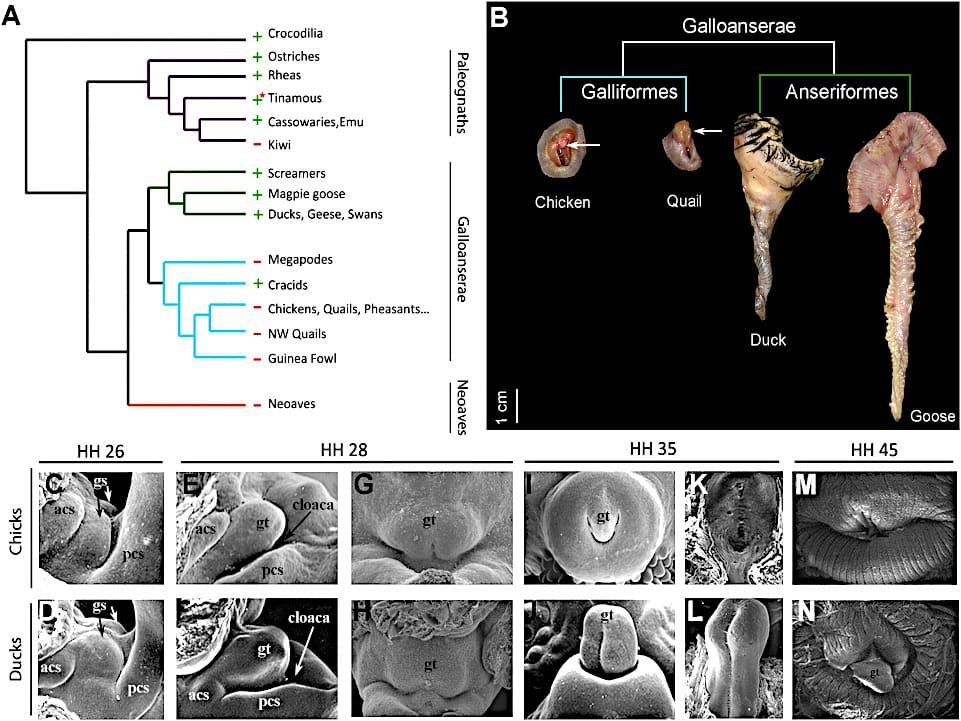
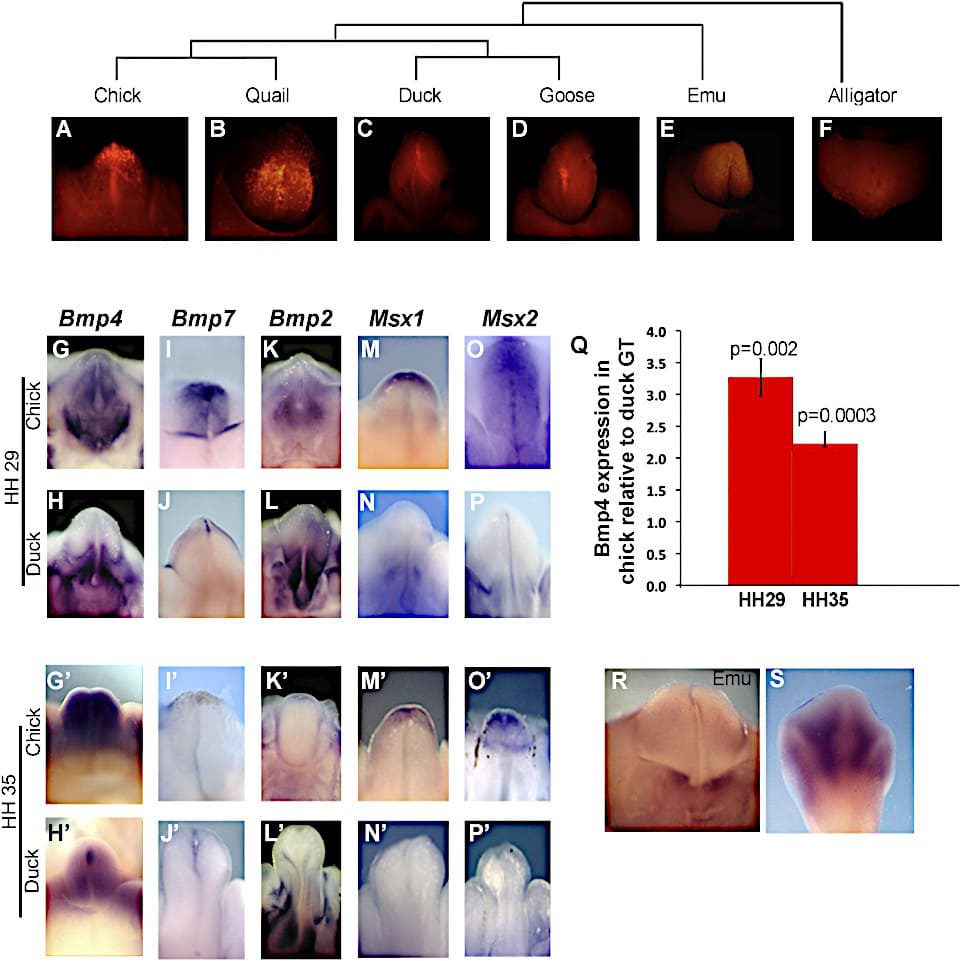
(A) Distribución filogenética de los falos intermitentes en las aves. + indica presente; – indica ausente o reducido en la mayoría de las especies del clasificado. ∗Most tinamous tienen un falo intermitente.
Los colores de las ramas son los siguientes:
- Púrpura, Paleognathae.
- Verde, Anseriformes.
- Cían, Galliformes;
- Naranja, Neo aves.
- Negro, Crocodilia (raíz).
(B) Preparados anatómicos de genitales externos masculinos adultos en dos anseriformes (oca y pato) y dos galliformes (pollo y codorniz). Las flechas apuntan a la reducción de los falos en las especies galliformes.
La barra de escala representa 1 cm.
(C-N) Microscopía electrónica de barrido del desarrollo genital externo de pollitos y patos.
Anterior está a la izquierda en (C)-(F) y arriba en (G)-(N). Los embriones de pollos y patos inician la formación de hinchazones genitales apareadas (C y D), que forman un solo tubérculo durante la fase de crecimiento temprano (E y H). Los arrestos por crecimiento excesivo y la regresión del tubérculo genital en los embriones de pollo (I, K, y M), pero el desarrollo genital continúa en los embriones de pato (J, L, y N). Los números de etapa de Hamburger-Hamilton (HH) se muestran arriba.
Abreviaturas: gs, hinchazón genital; gt, tubérculo genital; acs, hinchazón cloacal anterior; pcs, hinchazón cloacal posterior.
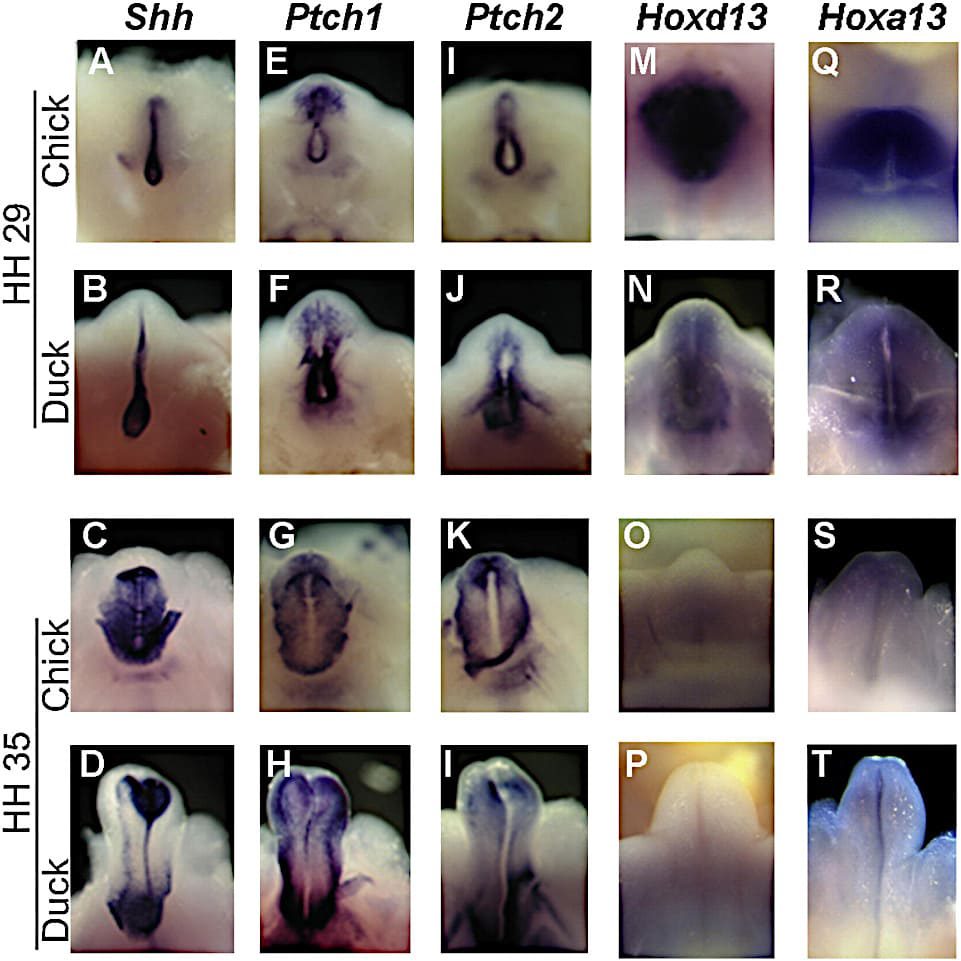
Las hibridaciones in situ de ARN entero de los tubérculos genitales de pollos y patos en los estadios 29 y 35 muestran patrones de expresión de genes que promueven el desarrollo genital externo del ratón.
Los tubérculos genitales se muestran en vista ventral con distal hacia arriba.
Los nombres de los genes se muestran en la parte superior; las especies y la etapa Hamburger-Hamilton (HH) se muestran a la izquierda.
(A-F) La coloración roja de LysoTracker muestra apoptosis generalizada en los tubérculos genitales galliformes (pollitos y codornices), mientras que los genitales anseriformes (patos y gansos), emúes y cocodrilos en etapas comparables muestran apoptosis limitada, principalmente a lo largo del surco. Las relaciones filogenéticas se muestran en la parte superior.
(G-P) Bmp4, Bmp7, Bmp2, Msx1 y Msx2 en pollitos y patos en el estadio 29 (G-P) y 35 (G′-P′).
Bmp4 (G y H), Bmp7 (I y J), Msx1 (M y N), y Msx2 (O y P) muestran expresión distal en los tubérculos genitales de los pollitos pero no de los patos en el estadio 29 (G-J).
Los dominios de expresión distal de Bmp4 (G′ y H′), Msx1 (M′ y N′), y Msx2 (O′ y P′) persisten en los tubérculos genitales de los pollitos hasta el estadio 35. Bmp2 no muestra diferencias significativas en ninguna de las dos etapas (K, L, K′ y L′).
(Q) qRT-PCR muestra que la expresión de Bmp4 es significativamente mayor en los tubérculos genitales (GT) de los pollitos en comparación con los patos en el estadio 29 (p = 0,002) y en el estadio 35 (p = 0,0003). Las barras de error muestran el error estándar de la media.
(R) En el tubérculo genital emú, la expresión de Bmp4 está ausente en la punta distal. La expresión se limita a la base del tubérculo y al cuello cloacal, como en los patos (compárese con H).
(S) Control interno del miembro posterior de la emu que muestra la expresión inter-digital de Bmp4.
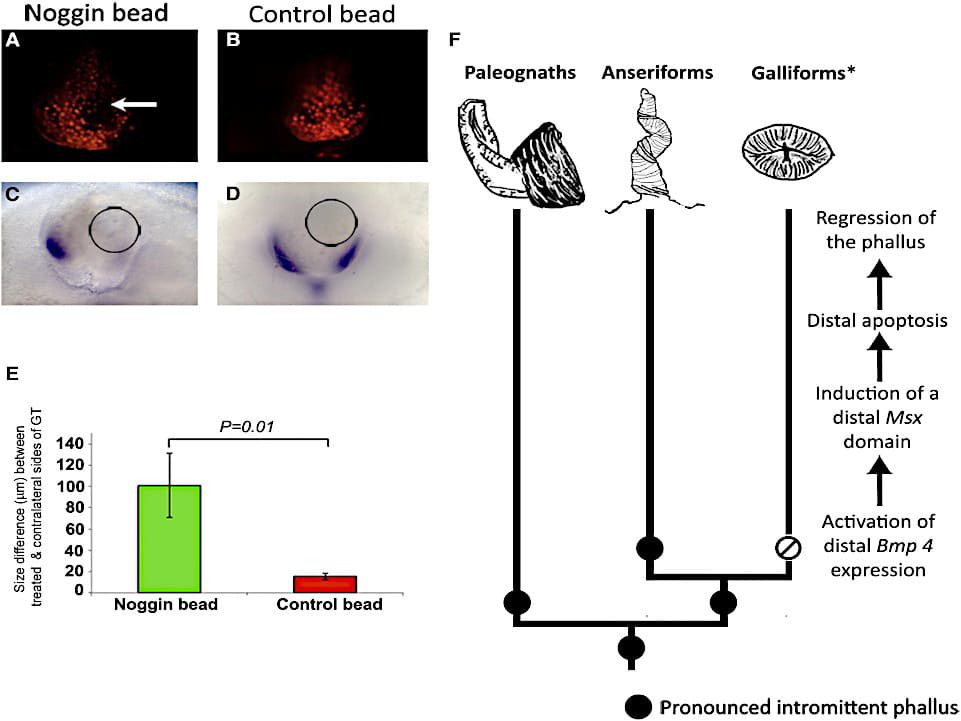
(A-D) Las perlas se cargaron con proteína Noggin
(A y C) o PBS (B y D) y se implantaron en el lado izquierdo (derecha en fotos) de los tubérculos genitales de los pollitos en etapa 29.
(A) Noggin bead (flecha) disminuye la apoptosis (los glóbulos rojos son positivos para LysoTracker) en el lado tratado de los tubérculos. El lado contralateral muestra apoptosis generalizada.
(B) La cuenta de PBS no tiene ningún efecto en ninguno de los lados.
(C) Msx1 está regulado hacia abajo en el lado del tubérculo con Noggin bead (círculo), pero la expresión se mantiene en el lado contralateral. Note que el lado tratado con Noggin muestra más crecimiento.
(D) Msx1 se expresa en un patrón normal a ambos lados del tubérculo que recibe la microesfera PBS (círculo).
(E) Comparación del crecimiento en los lados tratados versus contralaterales en los tubérculos genitales tratados con Noggin (verde) y PBS tratados con control (rojo) 24 horas después de la implantación de la microesfera.
Las cuentas de noggin indujeron un aumento medio de 100,8 μm sobre el lado contralateral, que es significativamente mayor que la diferencia entre el control de PBS y los lados contralaterales (15,8 μm; p = 0,01).
(F) Modelo de desarrollo para la pérdida evolutiva del falo intestinal en las galliformes. Los círculos negros indican la presencia de un falo intermitente; el círculo abierto con una línea diagonal indica la pérdida del falo intermitente; el asterisco indica todas las galliformes con excepción de los crácidos, que tienen un falo totalmente intromitente.
Resultados:
Los resultados muestran que los patos conservaron el patrón plesiomorfo de ambos con falos intromitentes.
También muestran que los patos conservaron el patrón plesiomorfo de la expresión de Bmp4 y la muerte celular, mientras que los pollos desarrollaron un nuevo dominio de muerte celular mediada por Bmp que causa la regresión del falo antes de la eclosión.
En conjunto, los resultados sugieren que la reducción del falo intromitente en aves galliformes, evolucionó no por la interrupción de las señales de crecimiento, sino por la activación de la muerte celular en el desarrollo del tubérculo genital.
Conclusiones:
Los resultados de los investigadores Ana M. Herrera, Simone G. Shuster, Claire L. Perriton, and Martin J. Cohn, indican que la reducción evolutiva del falo intestinal en aves galliformes, no se produjo por la interrupción de las señales de excrecencia, sino por la activación de novo de la muerte celular por Bmp4 en el tubérculo genital.
Estos hallazgos, junto con los descubrimientos que implican a los Bmps en la evolución de la forma del pico, las plumas y la falta de dientes, sugieren que la modulación de la regulación del gen Bmp jugó un papel importante en la evolución de la morfología aviar.
La comparación de la morfología genital masculina en dos anseriformes, la gallina de ganso gris ( Anser anser ) y el pato Pequín ( Anas platyrhynchos ), y en dos galliformes, la gallina doméstica ( Gallus gallus domesticus ) y la codorniz del Viejo Mundo ( Coturnix coturnix ), revela diferencias notables.
Los gansos y los patos tienen falos alargados y enrollados con espinas dérmicas, mientras que los pollos y las codornices sólo tienen inflamaciones fálicas rudimentarias en el borde anterior de la pared cloacal.
Aunque son muy reducidas, las inflamaciones fálicas de pollos y codornices conservan la polaridad proximodistal y dorsoventral y un surco ventral, lo que sugiere que el patrón genital temprano puede conservarse en embriones galliformes.
Los patrones de expresión similares de los genes que promueven el crecimiento en los genitales de pollos y patos, llevaron a investigar si la detención precoz del desarrollo genital en los pollos implica una falla de las células genitales del tubérculo. El análisis cuantitativo de la proliferación celular en el tubérculo genital de pollos y patos no reveló diferencias significativas..
Referencia bibliográfica:
Ana M. Herrera, Simone G. Shuster, Claire L. Perriton, and Martin J. Cohn. Developmental Basis of Phallus Reduction during Bird Evolution” Current Biology, Junio 2013
Os pueden interesar estos otros apartados
Quieres compartir, o comentar en tus redes sociales.
Escanéame